Elle doit répondre à un triple besoin :
- règlementaire : identifier les médicaments autorisés sur le marché ainsi que dans les bases publiques (notamment ANSM), suivre les médicaments dans le cadre de la pharmacovigilance, dans les bases médico-économiques mais aussi dans les études observationnelles rétrospectives et prospectives,
- logistique : identifier les médicaments à tous les stades des circuits d’approvisionnement ville et hôpital, dans les appels d’offres, les commandes et les factures, et permettre la traçabilité,
- remboursement : identifier les médicaments remboursables dans les systèmes d’information des acteurs intervenant dans le processus de remboursement et en premier lieu l’Assurance Maladie.
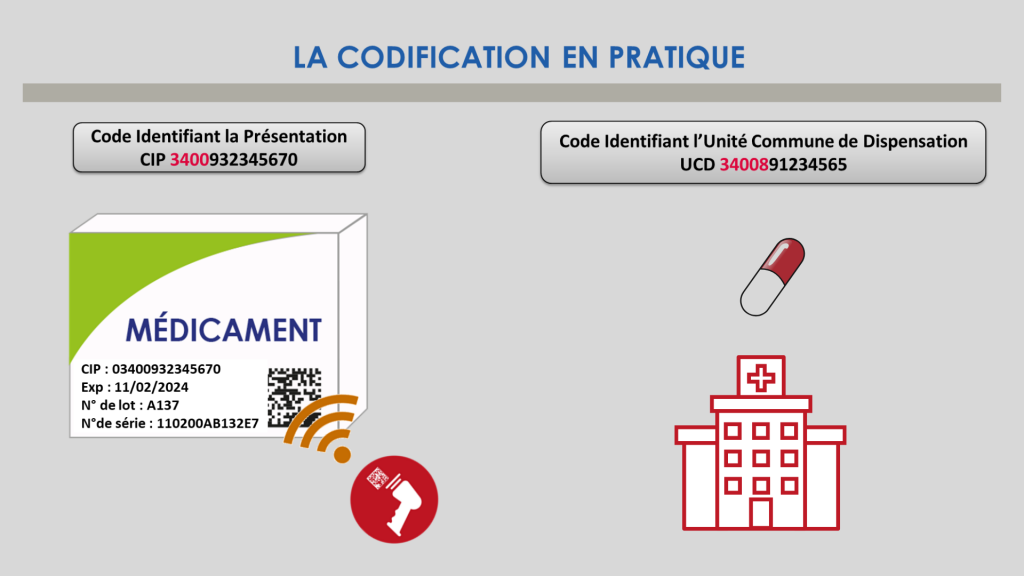
Depuis de nombreuses années les présentations des médicaments sont identifiées par le code identifiant de présentation (code CIP) qui répond pleinement à ces trois besoins.
De même, pour les besoins des établissements de soins, les unités communes de dispensation sont identifiées par un code identifiant l’unité commune de dispensation (code UCD) attribué à la demande du laboratoire.
Le cadre règlementaire de la codification des médicaments vient d’être clarifié et les codes utilisés officialisés par deux textes publiés au JO du 31 décembre 2021 :
Un Décret (n° 2021-1931) qui :
- précise que tout médicament autorisé en France dispose d’un numéro national d’identification et que, le cas échéant, les Unités Communes de Dispensation disposent aussi d’un numéro, ainsi les codes CIP et UCD entrent dans le code de la santé publique,
- donne mission à l’ANSM d’attribuer ces numéros avec faculté de délégation,
- renvoie à un arrêté le soin de déterminer les spécifications de ce numéro.
Un Arrêté qui fixe pour six ans les spécifications de ce numéro pour les Codes CIP et les codes UCD.
Ces spécifications reprennent sans changement les caractéristiques des codes CIP et des codes UCD utilisés depuis de nombreuses années.
- Il n’y a donc aucune modification de la codification des médicaments autorisés en France.
Ce cadre réglementaire est complété par une convention tripartite conclue début janvier 2022 entre l’ANSM, le CIP et GS 1 précisant les rôles de chacune des parties.
En parallèle, un travail a été initié il y a quelques mois par le ministère chargé de la santé pour définir le futur (à l’échéance de trois à six ans) système de codification des médicaments autorisés en France.
Dans ce cadre :
- un COPIL regroupant les acteurs concernés par la codification a été mis en place sous l’égide de la DGS,
- le COPIL analyse les solutions de codifications retenues par différents pays européens,
- le COPIL mène des interviews des acteurs publics et privés concernés par la codification des médicaments ainsi que d’experts en la matière.
L’objectif est que ces travaux débouchent, vers la fin du premier semestre 2022, sur des recommandations pour la future codification des médicaments en France avec un calendrier de mise en œuvre. Ce calendrier sera dépendant du système préconisé et notamment de la nature et de l’ampleur des éventuelles modifications / évolutions ou non par rapport à la codification actuelle.
Voir la communication du Ministère des Solidarités et de la Santé.
Voir la communication de l’Agence Nationale de Sécurité des Médicaments et des Produits de Santé.
In English : Communication on the issue of coding – Club Inter-Pharmaceutique
Depuis le 16 mars 2007 tous les présentations de médicaments en France doivent porter sur leur conditionnement un « Data Matrix, intégrant le code CIP à 13 caractères » pour la traçabilité au lot cf l’avis de l’ANSM https://www.legifrance.gouv.fr/jorf/id/JORFTEXT000000275479.